Analyse der Interaktionen des BMP4-Liganden mittels LRC
Vorgehen
- Die Ligand-Receptor Capture (LRC) Technologie erlaubt es, für einen bestimmten Liganden das Spektrum an Zelloberflächenrezeptoren, mit welchen er interagiert, zu bestimmen
- Zu diesem Zweck wird der Ligand mit einem speziellen Crosslinker modifiziert und dann mit Zielzellen inkubiert, welche die Rezeptoren exprimieren
- Bindet der Ligand an einen bestimmten Rezeptor, so stabilisiert der Crosslinker diese Interaktion und erlaubt die Identifikation des Rezeptors mittels Massenspektrometrie
- Dieses Verfahren wurde auf den in FOP (Fibrodysplasia ossificans progressiva) involvierten Liganden BMP4 angewendet, um Zielrezeptoren auf HEK293 Zellen zu identifizieren
Kontrollexperiment zur Aktivitätsbestimmung von BMP4-TriCEPS
- BMP4-Ligand wurde an den TriCEPS Crosslinker gekoppelt
- Um zu bestimmen, ob BMP4-TriCEPS detektierbar ist, wurde dieses mittels einer Dot Blot Methode getestet
- Als Kontrolle diente ein Standard-Ligand, INS-TriCEPS
- Wie unten sichtbar, kann BMP4-TriCEPS detektiert werden und ist somit funktionell
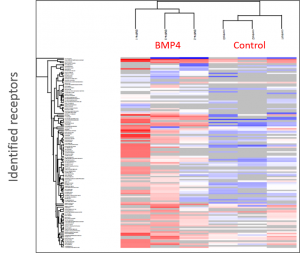
- Clusteranalyse der LRC-Datensätze
- Die Datensätze aus dem LRC-Experiment wurden gefiltert und verarbeitet
- Das Cluster-Diagramm zeigt BMP4-Daten im Triplikat gegen eine negative Kontrolle
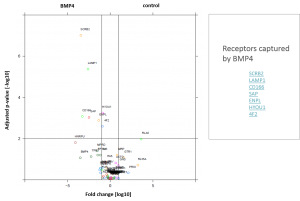
Volcano-Plot der identifizierten Rezeptoren
Resultate
- Es wurden 7 Rezeptoren identifiziert, welche spezifisch mit BMP4 interagieren
- Der ALK2-Rezeptor wurde nicht identifiziert
- Vier der identifizierten Rezeptoren sind in einem funktionellen Netzwerk zu finden, welches die Degradation von Rezeptoren reguliert:
- Lysosome membrane protein 2 (SCRB2)
- Lysosome-associated membrane glycoprotein 1 (LAMP1)
- Endoplasmin (ENPL)
- HYOU1
- Möglicherweise wurde der ALK2-Rezeptor nicht gefunden, da er nach seiner Aktivierung durch BMP4-Bindung sehr schnell von diesem oder ähnlichen Degradationskomplexen von der Zelloberfläche entfernt und degradiert wird